马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
1、简介
家禽疾病,尤其是常驻微生物群引起的感染,不仅严重影响动物福利,而且是家禽业造成难以挽回的毁灭性损失的原因。这些微生物导致生长减慢和产蛋量损失,从而除了导致死亡外还影响肉和蛋的产量。
败血症是家禽尤其是鸡死亡的重要原因,给全球家禽业造成巨大的经济损失。众所周知,几种细菌病原体,如大肠杆菌、多杀性巴氏杆菌、沙门氏菌属、金黄色葡萄球菌、副鸡禽杆菌、鼻气管鸟杆菌和克雷伯氏菌属。参与引起败血症。最近,几份关于禽类临床病例和鸡类实验研究的报告揭示了鸭鸡杆菌是与败血症相关的重要细菌病原体。
G. anatis属于巴氏杆菌科并感染一系列鸟类宿主物种,包括鸡、火鸡、鸭、珍珠鸡、鹅、野鸡、鸽子、孔雀和鹧鸪,并且在非鸟类宿主中也有报道,包括牛、马、猪、羊和兔子。 最近,这种细菌也从一名免疫功能低下的 26 岁女性身上分离出来,她患有菌血症和腹泻,在这种情况下,推测感染源可能是被G. anatis污染的食物。
在鸡中,G. anatis作为上呼吸道(鼻腔和气管通道)和下生殖器(泄殖腔和阴道)以及消化道(直肠)正常微生物群的一部分从临床健康的鸟类中分离出来。许多病原学和流行病学因素决定了G. anatis在鸡中的致病性,包括菌株、感染途径和宿主的生理状态。压力、免疫状态、年龄和激素等宿主相关因素往往在加重疾病严重程度方面发挥重要作用。与其他致病菌或病毒因子共同感染导致呼吸道损害,或目标宿主免疫抑制,以及环境因素的突然变化,如季节变化、寒冷应激、缺乏生物安全、营养不足、通风不良和过度拥挤,加剧了这种疾病。
据报道,G. anatis与传染性支气管炎病毒 (IBV) 的共感染会增加G. anatis的全身感染率,以及与其他细菌病原体相关的混合感染,例如因为大肠杆菌、副鸡粪曲霉和鸡毒支原体可能会加重鸡的疾病严重程度,导致发病率和死亡率增加。
G. anatis,特别是溶血生物变种,据报道可引起鸡的卵巢炎、输卵管炎、腹膜炎、肝周炎、肝坏死、心包炎、气囊炎、气管炎、肠炎和败血症。在产蛋母鸡中,生殖器官主要受到影响,这种细菌会产生包括出血性卵巢炎和卵巢卵泡破裂在内的病变。
G. anatis被认为是与产蛋量降低相关的主要生物,导致产量降低 8-10%,并发现在实验性免疫抑制蛋鸡中导致死亡率高达 73% 。在公鸡中,这种细菌会引起附睾炎并导致精液质量下降。在幼鸡中病变本质上是全身性的。
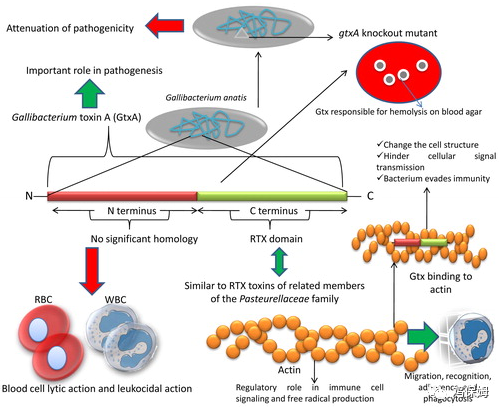
图 1.鸡杆菌毒素 A的结构和活性。Gtx是一种主要的毒力因子,与细菌的溶血特性有关
2、传播途径
通过呼吸道进行水平传播是最有可能的传播途径,已被广泛接受。另一种途径是垂直传播。这种现象最近已在含胚卵中进行了实验证明(Wang、Pors、Olsen 等人,2018 年),并通过经卵巢/输卵管途径或经蛋壳途径发生,但没有直接证据表明在胚胎发育中自然垂直传播体内。最近, G. anatis的跨蛋壳穿透和繁殖已通过实验记录并证明对鸡胚具有高度胚胎致病性。图 2描绘了G. anatis的不同传播模式。
图 2. Gallibacterium anatis的各种传播方式。报告了水平、垂直和性传播。在实验感染的母鸡中发现了鸡杆菌的垂直传播。
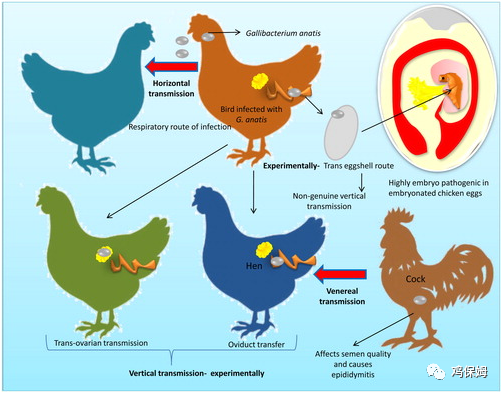
通过定量 PCR在四日龄的家禽中发现了G. anatis,并且在鼻内接种十天后也从成年母鸡的蛋黄和卵泡中分离出来,验证了垂直传播假说。G. anatis引起附睾炎并影响精液质量,与推测的性病传播一致。在自然情况下,生殖道器官主要通过上行感染受到影响。当细菌在有利的环境下进入自然栖息地的血管系统时,就会发生败血症。
3、流行病学、患病率和宿主范围
鸡杆菌在世界各地均有报道,例如瑞士、丹麦、德国、挪威、英国、瑞典、捷克共和国和奥地利等欧洲国家(Mráz 等人1976 年;Bisgaard 1977 年;Mirle 等人1991 年;Neubauer 等人2009 年) ;琼斯等人,2013 年);尼日利亚、埃及、摩洛哥等非洲国家(Addo 和 Mohan 1985 年;Elbestawy 等人2018 年;Nassik 等人2019 年);亚洲国家,包括中国、台湾、伊朗、叙利亚、印度和日本(Suzuki et al. 1996 ; Guo 2011 ; Huangfu et al. 2012 ; Singh 2016; 辛格等。2016 年;阿泰等人。2017 年;张等。2017 年;辛格等。2018 年);美国、加拿大、哥伦比亚、秘鲁和墨西哥等美洲国家(Hacking & Pettit 1974 年;Shaw 等人1990 年;Bojesen 等人2008 年;Mendoza 等人2014 年;Paudel、Liebhart、Aurich 等人2014 年;Paudel , Liebhart, Hess 等人,2014 年;Chávez 等人,2017 年);和澳大利亚 (Jordan et al. 2005 )。G. anatis, 特别是 biovar hemolytica, 由于它能够引起呼吸道和生殖系统感染,并且在欧洲、亚洲、美洲和非洲等各大洲的国家都有发生,最近变得很重要 (Neubauer et al. 2009 )。
G. anatis以前被认为是呼吸道的正常居民 (Bisgaard 1977 ) 和家禽下生殖道微生物群的常见部分 (Bisgaard 1993 ; Bojesen, Nielsen, et al. 2003 )。G. anatis在正常情况下也有报道(Harry 1962年;Bisgaard 1977 年;Mushin 等人1980 年;Bojesen、Nielsen 等人2003 年)并影响鸡和其他动物,如牛和猪(Gerlach 1977 年;Bisgaard & Dam 1981 年) ; Bisgaard 1993 ; Lin 等人2001; 克里斯滕森、比斯加德等。2003年;乔丹等。2005年;比斯加德等人。2009 年)。G. anatis也已从各种家养和非家养鸟类中分离出来(Mushin 等人1980 年;Bisgaard 1993 年;Bojesen、Nielsen 等人2003 年、Rzewuska 等人2007 年;Singh 2016 年;Singh 等人2016 年;2018 年)。Sorour 等人。( 2015 ) 也报道了鸭子的G. anatis感染。这种细菌在马、羊和兔子等其他家养动物中也有报道。
4、发病机制
G. anatis感染不会产生特定的临床症状或肉眼可见的病变。根据以前的病理学发现和最近对G. anatis进行分离的调查,发现G. anatis能够定植在上呼吸道而不会引起明显的临床症状。已在G. anatis中鉴定出几种毒力因子如前几节所述。这些细菌利用粘附和入侵作为它们最初的毒力机制。坚持之后是永久定植。粘附发生在宿主细胞上的细菌粘附素和受体之间。一旦细菌与宿主细胞表面建立牢固的粘附,它们就会大量繁殖并开始合成毒力因子。先前的研究表明,G. anatis在疾病过程中粘附在鸡口咽和输卵管上皮细胞上,这种粘附被认为对定殖上皮表面至关重要。
在免疫抑制条件下,这种机会性病原体侵入血液循环引起败血症,引起不同器官的炎症,导致心包炎、肝周炎、肝坏死、卵巢炎、滤泡出血和破裂、滤泡变性、输卵管炎、腹膜炎、肠炎和上呼吸道炎症。与其他微生物混合感染,例如细菌、支原体和病毒、激素影响、年龄 , 季节性变化 (冷) 胁应激和免疫损伤 是增强G. anatis致病性的诱发因素。
之前的一项调查表明,G. anatis是患有生殖道疾病的鸡中最常见的单一细菌感染。在公鸡中用G. anatis进行的实验性感染显示精液质量下降、精子密度降低、总活力改变以及膜完整性丧失。
5、疾病(1)临床表现与自然感染的家禽相关的临床症状
G. anatis感染的临床症状是非特异性的,多个系统都会受到影响。尽管G. anatis被归类为巴氏杆菌科,但由于其机会性致病性,该物种并未被认为是家禽养殖中的主要问题。与其他细菌性疾病一样,临床体征和病变是非特异性和混杂的。G. anatis当它从受临床影响的肉鸡和种鸡群中分离出来时,它就被称为一种有趣的药物。这种病原体能够在肉鸡的上呼吸道定植,不会引起任何症状或轻微的呼吸道体征,如罗音、咳嗽、感冒、呼吸困难、摇头、头部轻度肿胀和流鼻涕,而其他体征如腹泻、厌食、和全身消瘦也有报道。G. anatis导致产蛋量下降 3–18%。G. anatis感染与 0.06% 至 4.9% 的累积死亡率相关。2017 从墨西哥索诺拉地区的商业蛋鸡中收集了 23 株G. anatis分离株,这些蛋鸡具有呼吸和生殖临床症状。同样,在伊朗,G. anatis是从表现出生殖问题的鸟类中分离出来的。在埃及,从 26% 的有呼吸道症状和全身感染/败血症的鸭子病例中分离出G. anatis 。El-Hamid 等人最近进行的一项研究。( 2018 ) 在埃及发现 23% 的鸡肉有呼吸和繁殖问题的鸡群呈G. anatis阳性。
实验感染的家禽出现的临床症状
在用G. anatis对蛋鸡进行实验性感染后,在感染后7 至 24 天观察到白色腹泻,感染后第一周和第三周产蛋量分别下降 66% 和 47%。在后期,产蛋量逐渐上升,但仍明显低于未感染组的产蛋量。
在实验感染的G. anatis 无特定病原体 (SPF) 公鸡中未发现临床症状或肉眼损伤。然而,与未感染的对照组相比,受感染鸟类精液的稠度发生了显着变化。发现临床症状被夸大时G. anatis与A. paragallinarum 在 SPF 白来亨鸡中同时感染。受感染的禽类表现出流鼻涕和眶下窦肿胀。与单一感染和未接种疫苗的鸡的症状相比,同一实验显示合并感染组的呼吸道症状更严重。在含胚鸡蛋中,G. anatis通过穿透蛋壳感染发育中的胚胎,并可能导致死亡率,这在大肠杆菌共感染的鸡蛋中通常更高。在另一项针对商品肉鸡的实验性感染研究中,与未感染组相比, G. anatis感染导致感染组抑郁、呼吸罗音、咳嗽、打喷嚏、结膜炎、流泪、饲料和水摄入量减少以及体重减轻。
(2)大体病理在自然感染的家禽中
G. anatis影响鸡的泌尿生殖系统、胃肠道和呼吸系统。这种细菌与败血症、卵巢和输卵管炎症、卵泡变性以及肠道、腹膜和呼吸道感染有关。虽然G. anatis是呼吸道和生殖道的正常栖息者,但在有利条件下它会导致生殖和系统问题。可以在关节、肉垂、肺、腹部、心脏和其他内脏器官(包括脑组织)中检测到该生物体。之前的一份报告描述了在 31 个蛋鸡群的 141 只鸡中,有 141 只鸡因繁殖问题进行了尸检,其中 6 只受影响的鸡群中的鸡对G. anatis感染呈阳性,这些疑似鸡出现腹膜炎 (21%)、出血性卵巢 (18%) 等病变,卵巢退化(40%)、输卵管出血(12%)、输卵管无功能(31%)、卵泡畸形(28%)和卵泡破裂(16%)。在少数鸟类中,还观察到纤维蛋白性肝周炎 和心包炎 。
在实验感染的家禽中
在蛋鸡的实验性G. anatis感染中描述了一系列大体病理学特征,包括卵泡破裂、出血性卵泡、心包炎、多灶性肝坏死、卵变性、腹膜感染以及腹部炎症和奶酪样沉积物。据报道,肉眼病变的严重程度因G. anatis的品系而异,并且已通过实验证明。菌株 7990(生物变型 3),从受临床影响的墨西哥鸡身上获得,在实验性感染后产生腹膜局灶性或广泛性炎症,导致浆液性脓性纤维蛋白液渗出,卵巢血管扩大,输卵管和腹膜也与化脓性卵巢炎有关。此外,一些实验研究报告了鸡的卵巢退化和变形以及渗出性局灶性至弥漫性输卵管炎。在实验性感染中也报道了诸如轻度卡他性气管炎、肺部充血、气囊炎、心包炎、气管腔内干酪样物质积聚、腹水和肝充血等肉眼病变。
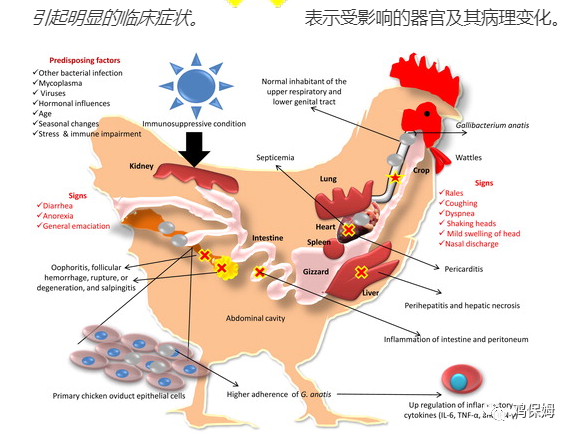
图 3描述了家禽中G. anatis感染的发病机制和临床症状的概述。
(3) 组织病理学
目前,尚无G. anatis在自然感染的鸡体内产生显微损伤的报道,但已有数项关于该菌引起的组织病理学实验报道。
1. 呼吸器官
在鸡身上实验性鼻腔接种G. anatis后,在呼吸道中产生了包括坏死、浸润、炎症和渗出在内的微观损伤,表明呼吸道成分如气管、肺和气囊的趋向性。据报道,最严重的损伤与G. anatis CCM 5976 菌株有关。病变包括气管上皮下层多灶性坏死伴淋巴细胞浸润,中度炎症伴气囊内纤维蛋白、淋巴细胞和嗜异细胞渗出。在肺部,有支气管杯状细胞增生和支气管淋巴结增生的报道。在另一项实验性G. anatis或G. anatis - A. paragallinarum共感染鸡研究中,观察到的眶下窦和鼻甲骨的组织病理学发现是炎症细胞浸润,以单核细胞和嗜异细胞为主,粘膜厚度增加和坏死和上皮脱落。商业肉鸡中几乎没有其他类似的近期实验性G. anatis感染报道了杯状细胞活性增强、上皮衬里增生和气管组织中炎症细胞浸润。肺血管严重充血、出血、炎性细胞浸润、大血管血栓形成伴血管周围出血、心房融合、管腔内含红细胞的纤维蛋白渗出物,以及肺组织中伴有肉芽肿性病变的间质性肺炎。在气囊中,有局灶性上皮增生、上皮变性、水肿引起的膜增厚和炎症细胞浸润的报道。
2. 肝脾
肝脏中的微观损伤已被记录在几个实验性感染中,这些实验用选定的G. anatis菌株对鸡进行了感染。这些病变包括多灶性坏死、胆管增生和离散肉芽肿结节中的多灶性淋巴细胞和嗜异性浸润。在其他一些类似的实验中,鸡的脾脏组织静脉内接种细菌显示嗜碱性细菌微菌落以及坏死的脾细胞和椭圆体中的嗜酸性物质。
3. 生殖器官
炎性细胞浸润到卵泡中通常在G. anatis感染的蛋禽中被发现。实验性鼻腔接种G. anatis在蛋鸡中诱导了输卵管损伤,包括滤泡内和/或滤泡周浸润。病变或轻或重。浸润细胞包括嗜异细胞和单核细胞 。在第 28 天用G. anatis (分离株 06-7484-1 TR)对小鸡进行实验性感染导致睾丸中的淋巴细胞浸润以及生精小管的退行性变化。 在 SPF 公鸡中进行的类似实验表明,在不同时间间隔,附睾间质区域的单核细胞多灶性聚集。
6、诊断
正在评估用于诊断G. anatis的多种方法,例如表型和培养特征、生化测试、MALDI-TOF、常规物种特异性 PCR、qPCR 以及受感染鸡的肉眼和显微镜病理检查。这种生物体分布到各种内脏器官可以通过免疫组织化学和原位杂交分别使用特异性抗体和探针来证明。G. anatis诱导的鸡炎症可以通过检测一些急性期蛋白如卵转铁蛋白 (OTF) 以及量化炎症介质来诊断。通常观察到的促炎细胞因子是 TNF-α、IL-6 和 INF-γ 。此外,用于菌株表征的其他基因型方法包括 DNA-DNA 杂交、脉冲场凝胶电泳 (PFGE)、扩增片段长度多态性 (AFLP)、16S rRNA 分析和测序基因,如infB、recN和rpoB。
1. 血凝试验
G. anatis可以凝集肉鸡、蛋鸡、鹌鹑、兔子和猪的红细胞。可以使用新鲜的红细胞悬液以及戊二醛固定的肉鸡红细胞。血凝活性可以用 1% 戊二醛固定的鸡红细胞悬浮在含有 0.01% 硫柳汞的 PBS 中通过微量稀释法/微量滴定板使用纯化的蛋白质或G. anatis来测定。
2. 溶血和细胞毒性试验
GtxA 毒素主要负责溶血和细胞毒性。可以使用牛血进行溶血测定。在三氯化钠 (TN) 缓冲液(10 mM Tris-HCl,0.9% NaCl,pH 7.5)中,反复洗涤血液,直到液体层变为无色。然后,将洗涤过的红细胞与无菌细菌培养上清液以 1:1 的比例在 37°C 下孵育 1 小时。通过 ELISA 在 540 nm 处对溶血时释放的血红蛋白量进行量化。细胞毒性测定可以通过将 HD11 细胞接种在 96 孔板中,添加细菌或过滤除菌的细菌培养上清液,然后在 37 °C 和 5% CO 2下过夜孵育来进行。
3. 共聚焦免疫荧光显微镜
从对数生长期中期制备的G. anatis培养样品用多聚甲醛固定在载玻片上,用 BSA 封闭,并用抗 FlfA 免疫血清孵育。罗丹明 RedX 偶联的山羊抗兔二抗用于检测。然后,使用合适的封片剂(如 ProLong Gold 抗淬灭试剂)对载玻片进行封片,并使用激光扫描显微镜捕获图像,并使用合适的软件进行分析。
4. 电镜
对于这种方法,将G. anatis培养到对数中期,并将获得的细胞用 PBS 处理。将 20 微升G. anatis悬浮液分配到涂有 Formvar-carbon 的镍网格上。然后将细胞在多聚甲醛中固定 15 分钟。抗 FlfA 免疫血清漂浮在这些镍网格上,随后漂浮在已与金颗粒结合的二抗上。使用透射电子显微镜检查这些网格。
5. 卵转铁蛋白血清学
急性期蛋白 (APP) 被认为是很好的标记物。它们具有重要的诊断和预后潜力,因为它们在血清中的水平受炎症相关事件的影响。卵转铁蛋白 (OTF) 被认为是鸡APPs 中的阳性生物标志物之一,并且被认为是一些特定细菌感染的必要诊断生物标志物。在鸡的炎症期间,OTF 可以增加 2 倍至 ≥ 10 倍,并且已经报道了由大肠杆菌引起的鸡感染中的 OTF 升高。具体的鸡APP 浓度可以通过 ELISA 有效量化。最近,鸡OTF-ELISA 已被用于评估血清 OTF 浓度,作为实验性G. anatis感染褐层鸡的 APP 。
6. 免疫组织化学 (IHC)
最近,免疫化学已被用于评估G. anatis病原体在宿主原代鸡 输卵管上皮细胞 (PCOEC) 中的粘附和侵袭,使用在兔中培养的抗G. anatis多克隆血清和 HRP 标记的山羊抗兔抗体。该 IHC 测定表明G. anatis病原体能够在不侵入的情况下附着上皮细胞。
7. 荧光原位杂交 (FISH)
这种诊断工具在确定G. anatis的传播和阐明其在实验和自然感染中的发病机制方面非常有效。它已通过使用花青染料 3.18 标记的原位杂交探针 (GAN850) 有效地证明,该探针靶向 Gallibacterium 的 16S- rRNA。这种杂交技术已被用于了解实验感染鸡的脾脏和肝脏组织的致病性改变并进行了评估。
7.8. MALDI-TOF MS(基质辅助激光解吸/电离飞行时间质谱法)
MALDI-TOF MS 一直是识别G. anatis的有用应用。该技术用于通过产生指纹图谱,根据蛋白质/肽分子的大小来识别生物标志物。它们大量存在并且是具有多种功能的管家基因的产物。它们包括核糖体蛋白或 DNA 或 RNA 结合蛋白。MALDI-TOF MS 需要更小的样本量,花费更少的样本分析时间,并且可以同时处理大量样本,因此具有巨大的常规实验室使用潜力。
通过 MALDI-TOF MS 全细胞指纹图谱分析 66 个鸡杆菌参考菌株,快速准确地鉴定和区分了 4 个公认的鸡杆菌种,未来可能将G. genospecies III作为第五种。此外,通过这种方法在许多鸡群中发现了G. anatis的一个克隆谱系。
9. 聚合酶链式反应 (PCR)传统鸡杆菌特异性 PCR
许多细菌病原体,包括巴氏杆菌科的成员,可能会根据表型和培养特征提出鉴别诊断问题。为了克服误诊,已经开发并广泛使用了明确的基因型诊断工具,如 PCR。与巴氏杆菌科的其他成员相比,鸡杆菌中独特的 16S 至 23S rRNA 内部转录间隔区序列 (ITS)可用于基于 PCR 的诊断。寡核苷酸引物(表 2) 的 16S rRNA 基因基于 99 个序列,代表所有鸡杆菌属和与其相关的巴氏杆菌科成员通常用于常规 PCR。引物 1133fgal (5'-TATTCTTTGTTACCARCGG) 对鸡杆菌有特异性,但对其他巴氏杆菌科成员没有特异性。23S rRNA 基因序列引物 114r (5'-GGTTTCCCCATTCGG) 已广泛用作反向引物 。此外,已经进行了许多研究以使用内部转录间隔区 (ITS)-PCR 鉴定鸡杆菌,它产生了大约789、985和 1032 bp 的三个特定扩增子; 。在许多情况下,很难根据表型识别这组细菌,因此,基于 DNA 依赖性 RNA 聚合酶 ( rpoB ) 的 β 亚基基因序列的分类在这些情况下可能很有用。
表 2. Gallibacterium anatis的 PCR 引物列表。
还可以进行 PCR 来检测一些毒性基因,例如 GtxA 编码基因 ( gtxA ) 和菌毛基因 ( flfA )。特异性扩增可以通过使用靶向这些序列的引物来完成。对于gtx –N 总站和flfA,引物 GalNtxF-TGCGCAGAAGTGCTAAATGAAG、GalNtxR-GGATAATCGTTGCGCTTTG和1162F-CACCATGGGTGCATTTGCGGATGATCC、1162R-TATTCGTATGCGATAGTATAGTTC 已分别使用。
实时定量 PCR (qPCR)
可以利用实时定量 PCR (qPCR)对G. anatis进行物种特异性鉴定。该技术还可以帮助量化G. anatis。促旋酶 B 亚基基因 ( gyrB ) 包含G. anatis特有的序列。它高度保守,以单拷贝基因的形式存在于原核生物中。蛋白质 gyrB 对于 DNA 旋转酶(一种 DNA 复制酶)的功能很重要,因为它编码该酶的 ATP 酶结构域。因此,gyrB被认为是诊断测试的生物标志物。该基因可以使用特异性引物(正向 CGATTGTGTCCGTTAAAGTGC、反向 TGCAAACGCTCACCAACTG)和 TaqMan 探针(FAM-CCACTACACTTTTCACTCGG AAGAAACCAG-BHQ)进行扩增。Wang 等人开发的这种 qPCR 测定法。( 2016 ) 被假定为高度特异性、敏感性和可重现性。与常规PCR(78%)和培养(34%)相比,其检出率为97%。Huangfu 等人开发的另一种 qPCR。( 2018 ) 目标gtxA基因显示出比基于gyrB基因的 qPCR 更好的检出率。一般来说,qPCR 需要较低浓度的 DNA 模板,此外,与传统的 PCR 和表型鉴定相比,它花费的时间更少且具有成本效益。
环介导等温扩增 (LAMP) PCR 测定
最近,针对G. anatis开发并验证了实时 LAMP 。这种方法对于G. anatis似乎是快速和特异的。该测定需要 6 组引物来扩增sodA基因,这是G. anatis中的一个保守区域。在 LAMP-PCR 中,在 63 °C 下进行等温扩增 60 分钟,该方法可在 34 分钟内检测低至 0.2561 pg 的 DNA。该测试被描述为对G. anatis高度敏感。其特异性高,对G. anatis检测具有诊断价值。这种方法比定量 PCR 更快、更便宜。
10. 荧光激活细胞分选 (FACS) 分析
可以通过 FACS 检测表达菌毛/抗原的细菌细胞。G. anatis可以在对数生长期中期通过离心从液体脑心输液 (BHI) 的培养物中收获。然后,细菌细胞用 1% 多聚甲醛固定,并悬浮在 PBS 中的 1% BSA 溶液中。将细菌细胞数约为 2.5 × 10 6的样品倒入圆底 96 孔板的孔中。将抗 FlfA 免疫血清加入孔中并孵育板。常见的异硫氰酸荧光素 (FITC) 偶联的山羊抗兔二抗就像染色剂一样起作用,有助于检测。抗 FlfA 免疫前血清可用作阴性对照 (Bager, Nesta, et al. 2013 )。
7、治疗和预防
虽然G. anatis感染通常可以用抗菌药物治疗,但也有一些无反应病例和复发的报道。G. anatis的多重耐药菌株经常被报道,这些菌株对磺胺类药物、新生霉素、泰乐菌素、克林霉素、四环素和青霉素表现出耐药性。Bojesen、Vazquez 等人。报告说,大多数G. anatis菌株 (65%)在体外研究中具有多重耐药性,并且发现只有两种菌株对所有测试的抗生素/药物敏感。在测试的田间菌株中显示主要对四环素 (92%) 和磺胺甲恶唑 (97%) 具有抗性。已在G. anatis中鉴定出导致四环素抗性的基因 tet (B)、tet (H) 和 tet (L)。在印度,Singh ( 2016 ) 报道G. anatis对庆大霉素、氯霉素、阿奇霉素、呋喃妥因、氨苄青霉素、亚胺培南、美罗培南和厄他培南敏感。El-Adawy ( 2018 ) 报告了对G. anatis对安普霉素、氟苯尼考和新霉素耐药,但对克林霉素、磺胺噻唑和青霉素耐药。据报道,大约 93% 的测试田间菌株对磺胺甲氧嘧啶具有抗性,93% 对大观霉素具有抗性,87% 对泰乐菌素具有抗性,80% 对土霉素具有抗性。由于菌株的抗生素敏感性不断变化,因此需要对分离株进行定期体外评估。Chávez的一份报告描述了对青霉素、泰乐菌素、林可霉素、氨苄西林、恩诺沙星、土霉素、诺氟沙星和头孢氨苄的显着耐药性;但对头孢噻呋 (73%) 和氟苯尼考 (68%) 敏感。Hess 等人最近进行的一项抗菌调查。( 2019) 报道,96% 的蛋鸡分离株对不同抗生素具有多重耐药性,其中大多数分离株对四环素 (89%)、泰乐菌素 (95%)、恩诺沙星 (58%)、萘啶酸 (77%) 和磺胺甲恶唑 ( 77%)。各种基因已被确定为导致G. anatis对抗生素产生抗性的原因。G. anatis中的 tet (31) 基因赋予了对四环素的抗性。广泛的抗生素耐药性的发展,导致治疗无效。沸石是铝硅酸盐矿物,最近被发现在饲料中补充时可有效减少家禽中约 97% 的G. anatis微生物。在最近的一项实验研究中,针对 GtxA 的重组 N 末端产生的特异性鸡蛋黄抗体在G. anatis攻击的鸡中显示出相当大的抗病保护作用,导致腹膜、肝脏和十二指肠的严重损伤较轻(Zhang 等人. 2019 年)。
应采取适当的预防、治疗和控制措施,如及时接种疫苗、选择性抗菌治疗和严格的生物安全措施,以保护同时感染其他细菌或病毒感染和免疫抑制剂的鸡群 。任何降低禽类抗感染能力的压力都必须得到改善。必须通过定期清洁和消毒地板和巢穴材料来防止由于孵化蛋的粪便污染而导致的跨蛋壳传播。多重耐药菌株的进化、更大的抗原变异和受感染宿主对生物体的低效清除是预防该疾病的主要制约因素。
G. anatis拥有许多具有免疫原性潜力的蛋白质,在这些假定的候选疫苗中重要的是 GtxA、FlfA、Gab_2156、Gab_1309 和 Gab_2312。GtxA-N、GtxA-C、FlfA 等重组蛋白最近已被确定为潜在候选疫苗。最近对产生多价和联合疫苗的尝试已经能够使用单一疫苗接种来预防广泛的疾病。使用G. anatis和A. paragallinarum 开发的灭活疫苗(Volvac® Boehringer Ingelheim,Ingelheim,Germany)据报道,在实验攻击后保护免疫鸟类。用G. anatis的 OMV 免疫的蛋鸡表现出降低的病变严重程度和血清中 OMV 特异性 IgY 的更高滴度。据报道,OMV 和菌毛蛋白 FlfA 的施用可提供相当大的保护以防止G. anatis感染,表明这些抗原可作为未来潜在的针对G. anatis的候选疫苗。
已经评估了一种多面体复合疫苗候选疫苗的疫苗接种潜力。这项计算机模拟研究探索了四种免疫原性蛋白,如 Flfa、GTxA、Gab_1309 和 Gab_2348,用于表位检测和预测,并报告说这些蛋白具有免疫原性,可以产生有效的免疫反应。图 4显示了用于预防家禽G. anatis感染的不同类型的疫苗。
图 4.针对家禽中G. anatis感染的不同疫苗
8、结论和未来展望
G. anatis感染是导致家禽生产损失和死亡的诊断不足或被忽视的原因。这种机会性革兰氏阴性菌具有溶血性、白细胞性和许多其他毒力因子,可在有利于疾病的环境(例如免疫抑制条件和合并感染的存在)下损害呼吸道和生殖道。G. anatis引起局部和全身感染,导致罗音、咳嗽、呼吸困难、腹泻、缺陷和产蛋量减少、生长不良、消瘦和死亡。这些临床病理学症状对于许多其他家禽疾病很常见,因此正确的诊断需要常规和先进的测试。
先进的诊断和鉴定方法,如 MALDI-TOF MS、FISH、qPCR、常规 PCR 和测序,可与常规培养或生化检测一起用于快速和精确的诊断。目前,抗生素是广泛用于治疗家禽G. anatis感染的主要疗法。然而,包括青霉素、大环内酯类和四环素在内的常用抗生素的抗生素耐药性问题引起了人们的主要关注,尽管这种病原体仍然对头孢噻呋或氟苯尼考等新型抗生素敏感,但又不适合用于产蛋鸡。需要深入研究共感染期间的宿主-病原体相互作用,以阐明不同G. anatis生物变种的致病潜力。
正在探索各种免疫原的疫苗接种潜力,包括常规抗原 GtxA、OMV、菌毛抗原 (FlfA)、胶囊或新发现的 EF-Tu、CRISPR 和重组蛋白(GtxA-N、GtxA-C、FlfA)。很少有疫苗已经开发出来并正在接受评估。然而,为了长远的解决方案,正确认识这种疾病,揭示更多关于毒力因子和发病机制的细节,破译致病性的分子机制,确定G. anatis的抗性基因负责诱导抗菌素耐药性、通过确定有效的候选疫苗解决抗原多样性以及探索先进的治疗方案对于设计更好的预防和控制这种疾病的策略以应对这种细菌感染爆发造成的损失至关重要。
来源:鸡保姆,中南山 编译整理,致谢本文原作者:阿索克库马尔马里亚潘,帕拉尼维卢穆努斯瓦米,莫哈末,伊克巴亚图 ,鲁奇蒂瓦里等。
|